DIAGNOSTICO BACTERIOLOGICO 2024bbbbbb.pdf
- 2. Objetivos de la clase ◼ Conocer el esquema de diagnóstico microbiológico (toma de muestra- procesamiento-informe-interpretación) ◼ Conocer los métodos de diagnóstico microbiológico y las principales técnicas que se utilizan en cada uno de ellos. ◼ Interpretar los parámetros que determinan su validez y utilidad en la práctica médica
- 5. PACIENTE ENFERMO Diagnostico presuntivo •Clinico •Epidemiologico Dignostico microbiologico Diagnostico de certeza Directo Indirecto INFECCION BACTERIANA??? TRATAMIENTO
- 6. SOLICITUD DE LABORATORIO ◼ Nombre y apellido ◼ Historia Clínica ◼ Internación: sector- cama ◼ Estudios Solicitados ◼ Tratamiento antibiótico previo ◼ Diagnóstico presuntivo ??? ◼ Obra social ◼ Firma y sello del médico El éxito del estudio depende en gran medida de la comunicación entre el médico y el laboratorio.
- 7. CONCEPTOS BASICOS PARA LA TOMA DE MUESTRA ◼ Elegir el material que mejor represente el proceso infeccioso. ◼ Tomar la muestra en el momento adecuado y en lo posible ANTES de que el paciente reciba ATB. ◼ Obtener la muestra evitando contaminarla con la flora normal del paciente. ◼ Tamaño de la muestra adecuado. ◼ Evitar el agregado de ATB que inhiban el desarrollo. ◼ Utilizar un recipiente esteril y adecuado para su conservacion y transporte. ◼ Identificar la muestra correctamente .
- 8. MUESTRAS ◼ SANGRE ◼ ORINA ◼ MATERIA FECAL ◼ MUESTRAS GENITALES ◼ LIQUIDOS DE PUNCION ( LCR, ABSCESOS, ETC) ◼ BIOPSIAS ◼ CATETERES ◼ MATERIALES VIAS RESPIRATORIAS SUPERIORES ◼ MTERIALES VIAS RESPIRATORIAS INFERIORES
- 14. TOMA Y CONSERVACION DE LAS MUESTRAS Las muestras para estudios microbiologicos requieren la utilizacion de medios de transporte para mantener viables los microorganismos presentes en las mismas. Los medios de transporte que se utilizan con mayor frecuencia son Medio de Stuart Medio de Cary Blair
- 15. Temperatura ambiente Hemocultivos Temperatura ambiente Medio conservación para anaerobios Materiales para cultivo de germenes anaerobios Heladera Recipiente estéril Esputo/aspirado traqueal/BAL Heladera Recipiente estéril Temperatura ambiente Medio de transporte* Secreciones vaginales Secreciones oculares Exudados de fauces Heladera Recipiente estéril Orina Temperatura ambiente Medio de transporte* Materia fecal Temperatura ambiente Recipiente estéril (SF) Biopsias Temperatura ambiente Recipiente estéril Jeringa Liquidos de punción CONSERVACION ALMACENAMIENTO MATERIAL *Stuart; Cary Blair QUE HAGO CON LA MUESTRA? ¿COMO LA CONSERVO?
- 16. DIAGNOSTICO MICROBIOLOGICO II PROCEDIMIENTO TRADICIONAL ◼ Estudio microscópico ◼ Cultivos ◼ Identificación ◼ Pruebas de sensibilidad TÉCNICAS DE DIAGNÓSTICO QUE NO INVOLUCRAN CULTIVO ◼ Microscopía ◼ Detección de antígenos ◼ Anticuerpos monoclonales ◼ Técnicas moleculares ◼ Interpretación de los resultados ◼ Elaboración del informe final.
- 17. MICROSCOPÍA •MICROSCOPIO OPTICO Preparados en fresco Tinciones: Coloracion de Gram Coloracion de Ziehl Neelsen Coloracion de Giemsa Coloracion de Kinyoun •MICROSCOPIA DE FLUORESCENCIA Coloracion de naranja de acridina Coloracion de auramina rodamina Inmunofluorescencia •MICROSCOPIA DE CAMPO OSCURO •MICROSCOPIO DE CONTRASTE DE FASE
- 18. EXAMEN EN FRESCO
- 19. TINCION DE GRAM Streptococcus spp Staphylococcus aureus Neisseria gonorrhoeae Lactobacillus spp Corynebacterium spp Enterobacterias Pseudomonas spp
- 20. Treponema pallidum Campo oscuro Leptospira interrogans
- 21. IMPORTANCIA DE LA MORFOLOGIA MICROBIOLOGICA • Eleccion del esquema inicial de identificacion • Eleccion de las pruebas de sensibilidad antibiotica y los antimicrobianos a ensayar • Eleccion de los medios de cultivo • Diagnostico de infecciones por microorganismos dificiles de cultivar CLINICA •Reconocimiento fisiopatologico de la entidad clinica •Presuncion del foco etiologico • Eleccion de la terapia inicial • Diagnostico rapido de ciertas infecciones
- 22. EXAMEN MICROSCOPICO DE LCR DIPLOCOCOS GRAM (+) DIPLOCOCO G(-) COCOBACILO G(-) TINTA CHINA
- 24. MEDIOS DE CULTIVOS ◼ Solidos ◼ Líquidos ◼ Selectivos ◼ Diferenciales ◼ Enriquecimiento
- 25. ◼ ¿Cuánto tardan en crecer las bacterias? ◼ Todas las bacterias tardan lo mismo en crecer? ◼ Tiempo de incubación ◼ Condiciones de incubación (temperatura, O2)
- 27. ◼ Microscopia ◼ Utilización del metabolismo (utilización de azúcares, compuestos orgánicos, etc.) ◼ Demostración de toxinas y factores de patogenicidad ◼ Identificación serológica (látex) ◼ Identificación según características genotípicas (hibridación , PCR) ◼ Métodos automatizados ◼ FILM ARRAY ◼ PROTEÓMICA: MALDI-TOF IDENTIFICACION DE CULTIVOS
- 30. Y ahora que lo identificamos… ◼ QUE MAS HACEMOS?
- 31. El aislamiento del agente causal permite determinar la sensibilidad a los antimicrobianos Sensibilidad a un antibiótico Método difusión en agar con discos de Kirby & Bauer Método dilución (macrodilución ó microdilución) Concentración inhibitoria mínima (CIM). Concentración bactericida mínima (CBM).
- 33. ¿ Que información obtenemos? CBM/CIM Menor o igual a 2 ATB bactericida Mayor a 2 ATB bacteriostático Sensibilidad antimicrobiana
- 34. PRUEBA DE DIFUSION DE KIRBY BAUER Determinar el diámetro de la zona de inhibición alrededor de un disco de papel de filtro impregnado con un antibiótico Método simplificado que aproxima aun resultado semicuantitativo que se aproxima a una CIM En el método de Kirby Bauer, el microorganismo es inoculado en la superficie de una placa de agar, sobre el cual se colocan discos impregnados con una concentración conocida del antibiótico. Las placas se incuban por 16-18 horas a 35- 37°C. Cada disco contiene un antibiótico diferente
- 35. • DIFUSIÓN EN AGAR ó Kirby-Bauer Estandarizado para especies de crecimiento rápido Halo de inhibicion •BACTERIAS SENSIBLES •BACTERIAS MODERADAMENTE RESISTENTES •BACTERIAS RESISTENTES
- 36. Se mide el diámetro del halo.Si la bacteria no crece alrededor del disco y el diamétro es grande quiere decir que posiblemente sea sensible. El diametro del halo se correlaciona con La CIM . Los diámetros están estadarizados por el Comité Nacional de laboratorios Existe para cada bacteria aislada una tabla propia.
- 37. E-Test Gradiente de concentraciones en la tira µg/ml La diferencia con el disco, es que el disco contiene una sola concentración del antibiótico. Se observa la intersección del halo con la tira (tiene la CIM graduada ) SENSIBILIDAD ANTIMICROBIANA
- 38. BACTERIAS SENSIBLES: Son inhibidas por las concentraciones que el antibiótico alcanza en suero a dosis habituales y por cualquier via de administración inclusive la oral. SIGNIFICADO CLINICO DE LA PRUEBA DE KIRBY BAUER BACTERIAS DE SUSECPTIBILIDAD INTERMEDIA: Son inhibidas IN VIVO cuando se administra el antibiótico a dosis más altas de las habituales. BACTERIAS RESISTENTES: son inhibidas por concentraciones del antibiótico que Nunca son alcanzados IN VIVO.
- 42. DIA 1 MUESTRA EJ:orina,heces, sangre,etc Ej: sangre(suero) LABORATORIO Observación microscópica Ensayos rápidos Siembra de cultivos Serologia Informe preliminar Exámen de los cultivos Identificación rápida Aislamiento Pruebas bioquímicas Determinación de susceptibilidad a antibióticos PACIENTE INFECTADO?? INFORME FINAL DIA 2 DIA 3 Identificación completa
- 44. Erase una vez que estas enfermedades infecciosas no tenian tratamiento….
- 48. CLASIFICACION DE LOS ANTIBIOTICOS ◼ 1. SEGUN su ORIGEN (naturales, semisintéticos, sintéticos) ◼ 2. SEGUN su ACTIVIDAD ◼ 3. Por su ESPECTRO ◼ 4. Por su MECANISMO DE ACCION
- 51. •Según su espectro de acción: De amplio espectro De espectro ampliado De espectro reducido
- 52. POR SU MECANISMOS DE ACCION
- 54. BETALACTAMICOS Estructura química: Poseen anillo betalactámico en su estructura molecular
- 56. Inhibidores de la síntesis de pared bacteriana BETALACTAMICOS (PENICILINAS) ◼ Inactivan la síntesis de enzimas de la pared bacteriana. ◼ Se unen a transpeptidasas. Impiden el entrecruzamiento de mureína. Impiden la transpeptidación. ◼ Inhiben al inhibidor de las autolisinas. Pérdida de la viabilidad. ◼ BACTERICIDAS.
- 57. Inhibidores de la sintesis de pared bacteriana BETALACTAMICOS ◼ Penicilinas: naturales: penicilina G ( via parenteral ) Benzatinica (im) sódica (ev), V (oral) semisintéticas: Penicilinas R a penicilinas: meticilina/isoxazolicos Aminopenicilinas: amoxicilina, ampicilina Carboxipenicilinas:carbenicilina/ticarcilina Ureidopenicilinas:piperacilina, mezlocilina
- 58. Inhibidores de la sintesis de pared bacteriana BETALACTAMICOS ◼ Cefalosporinas De 1era generación: cefalotina, cefazolina/cefalexina cefadroxilo De 2da generacion: Cefuroxima/cefoxitina cefaclor (vo) De 3era generación: Cefotaxima,Ceftriazona,ceftazidima,cefope razona (cefixima vo) De 4ta generacion: cefepime
- 59. Inhibidores de la síntesis de pared bacteriana BETALACTAMICOS ◼ Carbapenemes: imipenem, meropenem, ertapenem, doripenem ◼ Monobactamos: aztreonam ◼ Inhibidores de betalactamasas: acidoclavulánico, tazobactam. Inhibidores de la sintesis de pared bacteriana NO BETALACTAMICOS (GLUCOPEPTIDOS) Vancomicina, teicoplanina, fosfomicina, bacitracina,cicloserina
- 60. Inhibidores de la sintesis proteica ◼ Aminoglucosidos: Estreptomicina, gentamicina,tobramicina,amikacina,kanam cina. ( 30S) ◼ Tetraciclinas: minociclina, doxiciclina. (30S) ◼ Cloranfenico (50S) ◼ Lincosaminas: clindamicina (50S) ◼ Acido fusidico (50S) ◼ Macrólidos: eritromicina, claritromicina, azitromicina (50S)
- 61. Daño al ADN bacteriano ◼ Quinolonas ◼ 1er generacion: acido nalidixico ◼ 2da generacion: norfloxacina, ciprofloxacina ◼ 3era generación Levofloxacina ◼ 4ta generacion Moxifloxacina Nitroimidazolicos: metronidazol,tinidazol benznidazol Inhibidores de la RNA polimerasa: rifampicina
- 62. FAMILIAS DE ANTIBIOTICOS -Beta-lactámicos: Penicillinas,Cefalosporinas, Carbapenemes, Monobactamos -Aminoglicósidos Amikacina, gentamicina -Tetraciclinas: Minociclina, Tetraciclina -Sulfonamidas y Trimetoprima -Quinolonas: Ac.pipemidico, ciprofloxcina, norfloxacina -Cloranfenicol -Polipeptidos Polimixina B, Colistin -Macrólidos Eritromicina, Claritromicina -Lincosamidas: Clindamicina, Lincomicina -Glicopéptidos: Vancomicina, Teicoplanina -Estreptograminas: Linezolid -Rifampicinas -Nitroimidazoles: Metronidazol Isoniacida, Etambutol, Pyrazinamida, Etionamida
- 63. INTERACCIONES ENTRE ANTIMICROBIANOS ◼ Sinergismo: la actividad debida a la combinación de antimicrobianos es mayor a la suma de los efectos inidividuales de cada uno de ellos. ◼ Antagonismo: la acción combinada de dos antimicrobianos , es menor que la del agente más efectivo solo. ◼ Indiferencia: la acción combinada de dos antimicrobianos no produce un efecto mayor que el predecible por las actividades individuales de cada uno.
- 64. ASOCIACIÓN DE ANTIBIÓTICOS PARA QUE SE USAN? ◼ Obtener un efecto bactericida máximo ◼ Evitar la aparición de mutantes resistentes ◼ Tratar una infección polimicrobiana
- 65. ANTE TANTOS ANTIBIOTICOS LOGRAMOS GANARLES A LAS BACTERIAS???
- 70. RESISTENCIA BACTERIANA A LOS ANTIBIOTICOS refleja la capacidad e los microorg de evitar el efecto inhibitorio del agte antimicrobiano ◼ NATURAL Se transmite hereditariamente y es propia de cada género ó especie. Ej: Proteus, Providencia, Morganella son resistente a los antibióticos polipeptídicos ◼ ADQUIRIDA Indica que un microorganismo inicialmente sensible a un determinado antiótico desarrolla resistencia al mismo. ✓ PRIMARIA ✓ SECUNDARIA - mutación genética - adquisición de material genético extracromosomal (plásmidos, transposones)
- 71. MECANISMOS DE RESISTENCIA A) Impermeabilidad B) Modificación enzimática del antibiótico C) Modificación del sitio blanco. D) Eflujo
- 72. BETA LACTAMASAS ◼ Enzimas que inactivan los antibioticos beta-lactámicos: penicilinas y cefalosporinas CLASIFICACION 1) Según su espectro: * espectro ampliado * espectro extendido 2) Según localización de los genes codificantes: *cromosómicas *plasmídicas 3)Según su localización: * extracelulares * periplásmicas
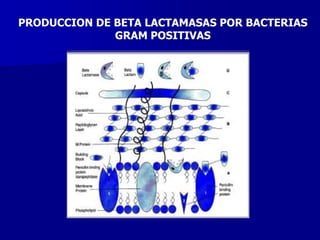
- 73. PRODUCCION DE BETA LACTAMASAS POR BACTERIAS GRAM POSITIVAS
- 74. PRODUCCION DE BETA LACTAMASAS POR BACTERIAS GRAM NEGATIVAS MECANISMO DE ACCION DE PENICILINA EN BACTERIAS GRAM NEGATIVAS
- 76. Modificación de sitio blanco ◼ Hay alteración de enzimas o sectores donde el antibiótico va ha ejercer su acción: mutaciones de la proteina S12 de la subunidad 30S codifica resistencia para Estreptomicina ◼ Mutaciones en genes Gyr A y Gyr B impiden que la quinolona se una a la ADN girasa de la bacteria ◼ Modificación de la proteína D ala-D ala ( cambia a D ala D lactato altera la unión de vancomicina a su sitio blanco
- 77. IMPERMEABILIDAD A LOS ANTIBIOTICOS
- 78. EFLUJO El mas importante en enterobacterias para tetraciclinas
- 79. Consecuencias de la Resistencia ◼ Aumento de la probabilidad de internación ◼ Aumento del tiempo de hospitalizacion ◼ Aumento del riesgo de infección hospitalaria ◼ Aumento del riesgo de muerte ◼ Mayor toxicidad ◼ Aumento de costos ◼ Generación de mas resistencia
- 86. MUCHAS GRACIAS