Módulo II, Tema 5: Taenia, Cysticercus e Hymenolepis
- 1. Universidad de Carabobo Facultad de Ciencias de la Salud Escuela de Bioanálisis Asignatura Parasitología FACULTAD DE CIENCIAS DE LA SALUD ESCUELA DE BIOANÁLISIS
- 2. ▪ Teniosis, Cisticercosis e Himenolepiosis. ▪ Taxonomía, Morfología y Ciclo Evolutivo. ▪ Mecanismos Patogénicos, Patología y Sintomatología. ▪ Diagnóstico clínico y de laboratorio. ▪ Epidemiología, Tratamiento y Profilaxis. MSc. Diana Graterol Parasitosis Intestinales: Céstodes
- 3. Céstodes: Teniosis, Cisticercosis, Himenolepiosis 3 TENIOSIS •Taenia solium •Taenia saginata CISTICERCOSIS •Forma larvaria de Taenia solium: •Cysticercus cellulosae HIMENOLEPIOSIS •Rodentolepis nana •Hymenolepis diminuta
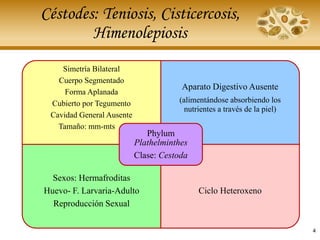
- 4. Céstodes: Teniosis, Cisticercosis, Himenolepiosis 4 Simetría Bilateral Cuerpo Segmentado Forma Aplanada Cubierto por Tegumento Cavidad General Ausente Tamaño: mm-mts Aparato Digestivo Ausente (alimentándose absorbiendo los nutrientes a través de la piel) Sexos: Hermafroditas Huevo- F. Larvaria-Adulto Reproducción Sexual Ciclo Heteroxeno Phylum Plathelminthes Clase: Cestoda
- 5. Céstodes: Teniosis, Cisticercosis, Himenolepiosis 5 Gusanos acintados Cuerpo en forma de cinta constituido de una serie de segmentos llamados proglótides
- 6. Clasificación Taxonómica 6 Adulto de T. solium Reino: Animalia Sub-reino: Metazoa Phylum: Plathelminthes Clase: Cestoda Orden: Cyclophyllidea Familia Taeniidae Familia Hymenolepididae Familia Dilepididae Orden: Pseudophyllidea Diphyllobotrium latum (poros genitales irregularmente alternos en las proglótides)
- 7. 7 Morfología Taenia Adulto Huevo Cisticerco Cysticercus cellulosae Cysticercus bovis T. solium T. saginata
- 8. 8 Morfología Adultos ❖ Gusanos largos y aplanados dorsoventralmente (1,5-12 metros) ❖ El cuerpo se encuentra dividido en 3 porciones. T. solium: 1,5-4 mts longitud T. saginata: 4-12 mts longitud
- 9. 9 Morfología Adultos Cuerpo dividido en: escólex, cuello y estróbilo. Estróbilo: proglótides jóvenes, maduras y grávidas. Proglótides grávidas Proglótides maduras Proglótides jóvenes Escólex Cuello
- 10. Morfología Escólex 10 Porción anterior o cefálica (1-2 mm), forma ovoide rectangular T. solium ❖ Cuatro ventosas ❖ Rostro o rostelo ❖ Corona ganchos o acúleos (25-30) T. saginata ❖ Cuatro ventosas ❖ Ausencia de rostelo ❖ Ausencia de acúleos
- 11. 11 Morfología Escólex T. solium
- 12. Morfología Cuello 12 Zona de crecimiento y proliferación celular del parásito Se originan los proglótides del estróbilo
- 13. Morfología Estróbilo 13 Proglótides: segmentos corporales que se separan y tienen vida propia.
- 14. 14 Morfología Estróbilo Útero Testículos Canal deferente Bolsa del cirro Poro genital Vagina Ovario Glándula vitelina Ootipo Organización de una proglótide madura
- 15. 15 Característica Proglótide Madura Taenia solium • 150-200 Masas Testiculares • Ovario Bilobulado + lóbulo accesorio • Vagina sin esfínter muscular Taenia saginata • 300-400 Masas Testiculares • Ovario Bilobulado • Vagina con esfínter muscular
- 16. 16 Característica Proglótides Grávidas Taenia solium •Pocas ramificaciones uterinas (7-15) de aspecto DENDRÍTICO •Se desprenden de 3-6 pasivamente en las heces Taenia saginata •Más largos que los de Taenia solium •Numerosas ramificaciones uterinas (15-30) de aspecto DICOTÓMICO •Se desprenden individualmente pasiva o activamente
- 17. Morfología Huevos ❖ Esféricos ❖ Pequeños (30-40 µm) ❖ Oncósfera ❖ Embrióforo 17 Huevo Taenia sp. Polen (Artefacto) Huevos Taenia sp. (Willis) Embrión hexacanto (oncósfera) Cáscara embriófora (estriada) Ganchos (acúleos) Son indistinguibles los huevos de T. solium de los de T. saginata
- 18. Morfología Cisticerco Vesícula llena de líquido con éscolex invaginado, 6-15 mm 18 Cisticerco evaginándose T. solium T. saginata Cysticercus cellulosae Cysticercus bovis
- 19. Ciclo Evolutivo Taenia solium 19 Hábitat: Intestino delgado Cysticercus cellulosae P.P: 3-4 meses P.I: 2-3 meses
- 20. Cisticercosis 20
- 21. Binomio Teniosis / Cisticercosis 21 Teniosis: Ingesta de forma larvaria de Taenia sp. Patogenia: Gusanos adultos. Cisticercosis: Ingesta de huevos de Taenia solium. Patogenia: Forma larvaria (cisticerco). Neurocisticercosis: Prevalencia 50 millones Mortalidad 50.000 casos/año
- 22. Ciclo Evolutivo Taenia saginata 22 Hábitat: Intestino delgado Cysticercus bovis P.P: 3-4 meses P.I: 2-3 meses
- 23. Patogenia y Patología 23 Gusanos adultos Alteraciones intestinales Teniosis Formas larvarias Lesiones tisulares Cisticercosis
- 24. Teniosis 24 Patogenia: Acciones expoliadoras Acciones inflamatorias Acciones irritativas Patología: Reacción inflamatoria local, Leucocitosis moderada, eosinofília (6-34%) Sintomatología: Dolor abdominal, náuseas, hambre, pérdida de peso, cefalea, diarrea, prurito anal.
- 25. Cisticercosis 25 Cysticercus cellulosae en músculo Cisticercosis ocular Neurocisticercosis Patogenia: Acciones mecánicas: Compresión Obstrucción Acciones inflamatorias Localizaciones: Sistema nervioso (60%), ojo (retina, vítreo), piel, tejido celular subcutáneo, músculo. Patología:
- 26. Cisticercosis 26 Sintomatología: Convulsiones Hipertensión intracraneana Lesiones oculares: dolor, visión borrosa “Depende del número de cisticercos presentes, su localización y a la respuesta inmune”
- 27. Diagnóstico Teniosis 27 Clínico Epidemiológico: ❖ Dolor abdominal, náuseas, apetito exagerado, pérdida de peso y enflaquecimiento Laboratorio: ❖ Métodos de demostración del parásito Directo (SSF y Lugol) CAT Método de Concentración: Willis, Kato, Faust Tamizaje de heces (diferenciación de proglótides)
- 28. Diagnóstico Parasitológico 28 Son indistinguibles los huevos de T. solium de los de T. saginata Huevos Taenia sp. (Willis) Huevo Taenia sp. T. solium T. saginata 7-15 ramificaciones uterinas Aspecto dendrítico Menos anchas. 15-30 ramificaciones uterinas Aspecto dicotómico Más anchas. Proglótides grávidas Tamizaje de heces
- 29. Diagnóstico Teniosis 29 ❖ Métodos inmunológicos Determinación de coproantígenos Determinación de anticuerpos ❖ Métodos moleculares Sondas de DNA PCR (PCR, Multiplex PCR, PCR-RFLP) PCR 389 pb 599 pb 170 pb
- 30. Diagnóstico Cisticercosis 30 Clínico Epidemiológico: ❖ Auto-infección con T. solium Laboratorio: ❖ Examen de heces ❖ Métodos inmunológicos ELISA Inmunoblot Inmunofluorescencia Hemaglutinación Inmunoelectroforesis Detección de Ag circulante Detección de Ac
- 31. Diagnóstico Cisticercosis 31 ❖ Métodos auxiliares Visualización imágenes: Rayos X, TAC, RMN Evaluación fondo de ojo Biopsias/autopsias LCR: Glucosa, Proteínas, Eosinófilos, Linfocitos
- 32. Ecología 32 Taenia solium: 2.5 millones parasitados Taenia saginata: 40 millones portadores Distribución mundial COSMOPOLITA Mayor incidencia: T. solium América Latina (Honduras, Nicaragua, Guatemala, Ecuador). África (Nigeria, Uganda, Ruanda, Angola). Sudeste Asiático. Mayor incidencia: T. saginata América Latina (Brasil, Perú, Panamá). África (Etiopía, Kenia, Zaire). Europa (Francia, Yugoslavia, Suiza, Siria, Líbano).
- 33. 33 Epidemiología Teniosis Reservorio o Fuente Infección: Hombre enfermo Antroponosis Forma parasitaria eliminación: huevos Mecanismo transmisión: Vía Oral Ingesta carne cruda o mal cocida Forma parasitaria infectante: cisticerco Hospedador susceptible: Hombre sano T. solium/ cerdo http://www.vetsci.usyd.edu.au/research/images/pig.jpg T. saginata/ vaca http://images.google.es/images?q=tbn:O9mUUAINU0YC:www.meatsafetestkits.com/images/cow.gif
- 34. 34 Epidemiología Cisticercosis Reservorio o Fuente Infección: Hombre enfermo Antroponosis Forma parasitaria eliminación: huevos Mecanismo transmisión: Vía Oral Ingesta huevos en agua y alimentos Forma parasitaria infectante: huevo Hospedador susceptible: Hombre sano
- 35. Tratamiento 35 Teniosis: ❖ Niclosamida ❖ Praziquantel ❖ Mebendazol ❖ Paronomicina ❖ Semillas auyama Cisticercosis: ❖ Praziquantel: Hospitalización y vigilancia Cisticercosis ocular: cirugía Acción Tenicida Acción Tenífuga
- 36. Profilaxis 36 Teniosis y Cisticercosis Tratamiento de los enfermos Adecuada disposición de excretas Cría de cerdos y bovinos en condiciones sanitarias adecuadas Condiciones higiénicas en general y educación sanitaria Control sanitario adecuado de las carnes Conservación de las carnes en congelación entre -10°C y -20°C por 12 hs y adecuada cocción
- 37. Conclusiones 37 T. solium T. saginata Cisticercosis “A” F.I.P. o Reservorio “B” Forma P. Infectante Puerta de Entrada Mecanismo Transmisión Hábitat Forma P. Eliminación - Medio de Eliminación - Puerta de Salida - Medio de Evolución - “C” Hospedador Susceptible Método Diagnóstico Elección Hombre Cysticercus cellulosae Pasivo – Carne mal cocida Boca Yeyuno Extraintestinal Proglótides grávidos Heces Ano Ganado porcino Hombre Tamizaje Heces HAI, ELISA, TAC, Rayos X Cysticercus bovis Huevo Agua, Alimentos Ganado bovino
- 39. 39 Himenolepiosis Rodentolepis nana: Ciclo Monoxeno Hymenolepis diminuta: Ciclo Heteroxeno Hosp. def. roedores (Hombre) Hosp. intermediarios Artrópodos Hymenolepis diminuta Rodentolepis nana
- 40. Clasificación Taxonómica 40 Adulto de R. nana Reino: Animalia Sub-reino: Metazoa Phylum: Plathelminthes Clase: Cestoda Orden: Cyclophyllidea Familia Taeniidae Familia Hymenolepididae Familia Dilepididae Orden: Pseudophyllidea Diphyllobotrium latum (poros genitales de abertura lateral y localizados en un mismo lado)
- 42. Morfología Adultos 42 Escólex R. nana Escólex H. diminuta Rostro o rostelo Ganchos (acúleos) Ventosas Ventosas R. nana: 2- 4 cm longitud H. diminuta: 30- 60 cm longitud
- 43. Morfología Huevos 43 Cáscara interna Cáscara externa Material granulososo Saliencias mamelonadas Cáscara interna Cáscara externa Embrión hexacanto (oncósfera) R. nana H. diminuta ❖ Ovoides, hialinos ❖ 2 mamelones polares ❖ Filamentos ❖ Oncósfera ❖ Embrióforo ❖ Sub-esféricos ❖ Grandes ❖ Sin filamentos ❖ > espacio entre membranas Embrión hexacanto (oncósfera)
- 44. Morfología Cisticercoide 44 ❖ Forma larval ❖ Forma esférica, pared gruesa ❖ Carente de líquido ❖ Presenta un escólex en cada vesícula
- 45. Ciclo Evolutivo Rodentolepis nana 45 Hábitat: Íleon Ciclo ± 20-30 días
- 46. Ciclo Evolutivo Hymenolepis diminuta 46 Ciclo ± 20-30 días Hábitat: Íleon Hosp Accid
- 47. Himenolepiosis 47 Gusanos adultos Trastornos gastrointestinales Himenolepiosis Acciones expoliadoras Acciones irritativas Acciones inflamatorias Patología: Procesos inflamatorios, infiltración de leucocitos, eosinofília (4-15%). Sintomatología: Anorexia, pérdida de peso, prurito, dolor abdominal, diarrea, vómitos.
- 48. Diagnóstico Himenolepiosis 48 Clínico Epidemiológico: Laboratorio: ❖ Métodos de demostración del parásito Directo (SSF y Lugol) Método de Concentración: Willis, Faust ❖ Métodos inmunológicos: poco útiles
- 49. Diagnóstico Himenolepiosis 49 Huevos R. nana Huevos H. diminuta
- 50. Ecología 50 20 millones personas infectadas Distribución mundial COSMOPOLITA Mayor incidencia: Sur Europa, Norte África, Medio Oriente, India y América Latina.
- 51. 51 Epidemiología Himenolepiosis Reservorio o Fuente Infección: Hombre enfermo Antroponosis Forma parasitaria eliminación: huevos Mecanismo transmisión: Vía Oral Ingesta agua y alimentos contaminados Forma parasitaria infectante: huevo Hospedador susceptible: Hombre sano
- 52. Profilaxis 52 Himenolepiosis Tratamiento de los enfermos Adecuada disposición de excretas Aseo personal adecuado Condiciones higiénicas en general y educación sanitaria Adecuada disposición final de basura Eliminación de plagas domiciliarias y ratones
- 53. Conclusiones 53 R. nana H. diminuta “A” F.I.P. o Reservorio “B” Forma P. Infectante Puerta de Entrada Mecanismo Transmisión Hábitat Forma P. Eliminación Medio de Eliminación Puerta de Salida Medio de Evolución - “C” Hospedador Susceptible Método Diagnóstico Elección Hombre Huevo Agua, Alimentos Boca Yeyuno – Íleon Íleon Huevos Heces Ano Artrópodos Hombre Willis Cisticercoide Roedores Artrópodos Roedores / Hombre
- 54. Bibliografía 54 ❖ Becerril MA. (2019). Parasitología Médica. 5ta Edición. México: Editorial McGraw-Hill Interamericana. ❖ Botero D, Restrepo M. (2019). Parasitosis humanas. 6ta Edición. Colombia: Corporación para Investigaciones Biológicas. ❖ Gállego Berenguer J. (2007). Manual de Parasitología: morfología y biología de los parásitos de interés sanitario. España: Edicions de la Universitat de Barcelona. ❖ Hómez J, Soto R, De Soto S, Méndez H, Mármol P. (2007). Parasitología, Libro de Texto. 11va Edición. Venezuela: Editorial de la Universidad del Zulia (Ediluz). ❖ Incani RN. (2012). Guía de Parasitología. Venezuela: Escuela de Medicina, FCS- UC. ❖ John D, Petri W. (2020). Markell & Voge's Medical Parasitology. 10ma Edición. USA: Editorial W.B. Saunders. ❖ Rey L. (2008). Parasitología. 4ta Edición. Brasil: Editorial Guanabara-Koogan. ❖ Rodríguez Pérez EG. (2013). Parasitología médica. 1ra Edición. México: Editorial El Manual Moderno. ❖ Todd A, Sanford L, Davidsohn P. (1988). Diagnóstico y tratamiento clínicos por el laboratorio. 8va Edición. Tomo I.